文章分享吸附的定义、原理、分类(物理吸附与化学吸附)及关键影响因素(吸附质性质、表面特性、温度、压力、pH值)。阅读本文,你可掌握吸附的基本机制、区别物理与化学吸附的关键特征,了解如何优化吸附过程,适用于化工、环保、材料等领域应用。
什么是吸附?
吸附(adsorption)是指物质在表面或界面上积聚并附着的现象,它涉及物质之间相互作用力的形成,通常发生在固体、液体或气体的表面。这一过程是物质在界面上与其它物质的相互作用的结果,广泛应用于化学工程、环境科学、生物学等领域。
吸附不仅仅是一种物理现象,它还可以通过化学作用力的介入形成更为复杂的吸附过程。因此,吸附现象可以通过物理吸附和化学吸附两种主要类型进行详细讨论。
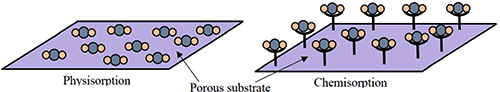
图1.气体分子与吸附剂表面在物理吸附和化学吸附过程中的相互作用示意图。
吸附的原理吸附过程的本质涉及到吸附质分子与吸附表面分子之间的相互作用,通常表现为分子或原子在界面上的聚集。吸附质的吸附力可能源自范德瓦尔斯力、电场力、氢键等物理作用,也可能是由共价键、离子键等化学作用力所主导。
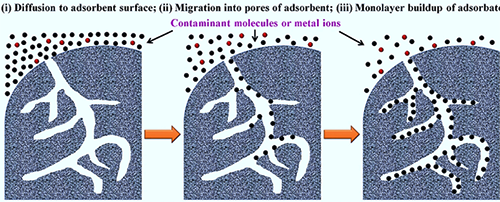
图2.多孔材料吸附流程图:(i)表面接触(外扩散),(ii)吸附(内扩散),(iii)单分子层吸附平衡。
吸附的分类根据吸附质与吸附表面之间作用力的性质,吸附可以分为两种主要类型:物理吸附和化学吸附。
物理吸附
物理吸附,也称为范德瓦尔斯吸附,是由于吸附质分子与吸附表面之间存在弱的范德瓦尔斯力或偶极力等物理作用力而发生的吸附过程。该过程通常是可逆的,并且不涉及化学键的形成。
在物理吸附过程中,吸附质分子和表面之间的相互作用较弱,因此通常需要较低的温度和压力才能实现吸附。当外部条件发生变化时,吸附质容易被脱附回到气相或溶液中。
物理吸附的特点是吸附量随着温度的升高而减小,反之则增加,且通常是单层吸附。物理吸附的一个重要特征是吸附过程的热力学可逆性,且吸附能量较低。
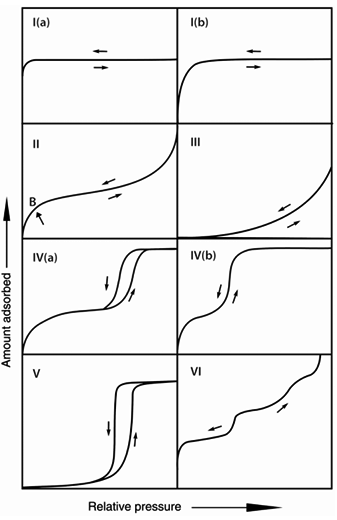
化学吸附
化学吸附,也称为化学结合吸附,是由于吸附质分子与吸附表面之间形成较强的化学键,如共价键、离子键等。该过程通常是不可逆的,并且具有较高的吸附能量。在化学吸附过程中,吸附质分子和表面之间的相互作用比物理吸附更强,因此化学吸附通常需要较高的能量(如较高的温度或压力)才能发生。
化学吸附的特点是吸附质和表面之间的相互作用是通过化学反应或者离子交换等方式实现的,通常涉及电子转移或原子重排等复杂过程。化学吸附不仅需要较高的温度和压力条件,而且吸附量可能会随着温度升高而增加,但其过程的可逆性较差
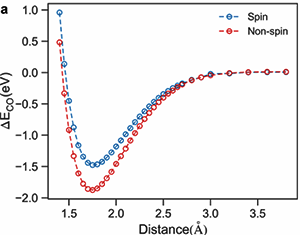
图3.CO在Co表面化学吸附的势能曲线示意图。
物理吸附与化学吸附的区别
物理吸附和化学吸附的主要区别在于它们的吸附机制和能量来源。
物理吸附主要依赖于分子间的弱相互作用力,如伦敦色散力、诱导偶极力和偶极-偶极力等,这些作用力的强度较弱,因此吸附过程通常是可逆的,并且不涉及化学键的形成。相比之下,化学吸附是由于吸附分子和表面之间形成化学键(如共价键或离子键),这通常是不可逆的,吸附能较高,可以达到几万焦耳每摩尔。
物理吸附的吸附能较低,通常在几千焦耳每摩尔的量级。因此,物理吸附过程对温度变化较为敏感,吸附物质容易脱附。而化学吸附的过程涉及更强的能量变化,因此不太受温度影响。
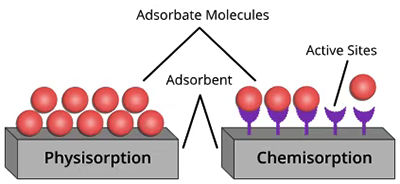
图4.物理吸附与化学吸附的直观对比示意图。
影响吸附的因素
吸附过程受到多个因素的影响,这些因素决定了吸附的程度和速率。主要影响因素包括吸附质的性质、吸附表面的性质、温度、压力、溶液的pH值等。
①吸附质的性质
吸附质的分子量、极性、分子结构以及其与吸附表面相互作用的能力是影响吸附的首要因素。较大分子量的吸附质通常会在表面形成较大的吸附层,而极性较强的分子则会通过电场作用或氢键与表面发生较强的相互作用。此外,分子内部的官能团如羟基、氨基等也会增加吸附质与表面之间的化学相互作用,从而改变吸附性能。
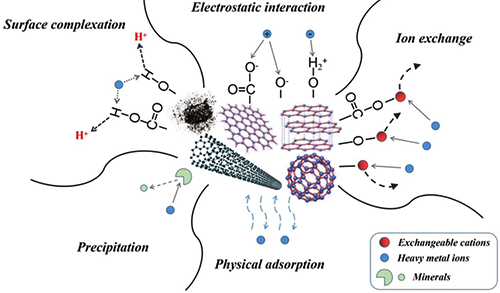
图5.重金属在碳基官能团吸附剂上的吸附机制示意图。
②吸附表面的性质
吸附表面的性质对于吸附过程至关重要。表面的比表面积越大,能够提供的吸附位点越多,吸附量通常也越大。
表面的化学成分、表面能和表面粗糙度也会对吸附过程产生影响。具有较高比表面积的材料,如活性炭、纳米材料等,通常具有较高的吸附能力。表面上的官能团也会通过提供额外的吸附位点来提高吸附效率。
③温度
温度是影响吸附过程的一个重要因素。在物理吸附过程中,随着温度升高,吸附质的分子运动加剧,导致吸附质与表面之间的弱相互作用减弱,吸附量通常会减小。
反之,化学吸附则可能随着温度的升高而增强,因为化学反应的速率常常随着温度升高而加速。然而,过高的温度也可能破坏吸附质与表面之间的化学键,导致吸附过程不可逆。
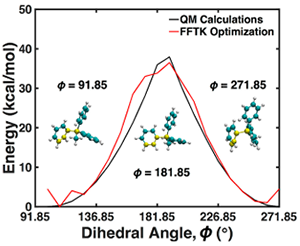
图6.MePh3P⁺中C–C–C–P二面角(黄色原子)在Φ=91.85°至271.85°范围内以15°为步长变化时的能量面比较。
④压力
吸附质的浓度与其在气相中的压力密切相关。在气体吸附中,随着气体压力的增大,吸附量通常会增加,直到达到吸附表面的饱和状态。这一现象在Langmuir吸附等温线中得到了广泛的描述。对于液体中的吸附过程,溶解度的增加通常伴随着吸附量的增大。
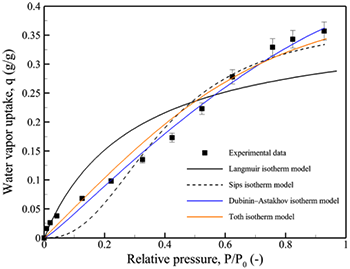
图7.硅胶在30°C下的平衡吸附等温线示意图。
⑤溶液的pH值
在液相吸附过程中,溶液的pH值对吸附过程也有显著影响。不同的pH值可能会改变吸附质的电荷性质以及吸附表面的电荷分布,进而影响吸附过程。酸性或碱性环境下,吸附质的离子化程度不同,这可能导致吸附效能的变化。







